Antecedentes y objetivos
Se han descrito episodios de hepatitis autoinmune después de la infección y vacunación por SARS-CoV-2, pero su fisiopatología sigue sin estar clara. En este documento, informamos el caso de un hombre de 52 años que presenta episodios bimodales de hepatitis aguda , cada uno de los cuales ocurre 2-3 semanas después de la vacunación con ARNm de BNT162b2. Intentamos identificar los correlatos inmunes subyacentes. El paciente recibió budesonida oral , recayó, pero logró la remisión con esteroides sistémicos.
Métodos
La citometría de masas de imágenes para el perfil inmunológico espacial se realizó en tejido de biopsia de hígado . Se realizó citometría de flujo para diseccionar fenotipos de células T CD8 e identificar longitudinalmente células T específicas de SARS-CoV-2 y específicas de EBV. Los anticuerpos inducidos por la vacuna se determinaron por ELISA. Los datos se correlacionaron con los resultados del laboratorio clínico.
Resultados
El análisis del tejido hepático reveló un infiltrado inmune dominado cuantitativamente por células T CD8 citotóxicas activadas con distribución panlobular. También se observó un enriquecimiento de células T CD4, células B, células plasmáticas y células mieloides en comparación con los controles. El infiltrado intrahepático mostró enriquecimiento de células T CD8 con especificidad por SARS-CoV-2 en comparación con la sangre periférica. En particular, la gravedad de la hepatitis se correlacionó longitudinalmente con un fenotipo citotóxico activado de células T CD8+ específicas de SARS-CoV-2 periféricas, pero no específicas de EBV, o inmunoglobulinas inducidas por la vacuna.
Conclusiones
La vacunación contra la COVID-19 puede provocar una hepatitis mediada por el sistema inmunitario dominante de linfocitos T distinta con un mecanismo patológico único asociado con la inmunidad residente en tejido específica de antígeno inducida por la vacunación que requiere inmunosupresión sistémica .
Resumen de laicos
La inflamación del hígado se observa durante la infección por SARS-CoV-2, pero también puede ocurrir en algunas personas después de la vacunación y comparte algunas características típicas con la enfermedad hepática autoinmune . En este informe, mostramos que las células T altamente activadas se acumulan y se distribuyen uniformemente en las diferentes áreas del hígado en un paciente con inflamación hepática después de la vacunación contra el SARS-CoV-2. Además, dentro de la población de estas células T que infiltran el hígado, observamos un enriquecimiento de células T que son reactivas al SARS-CoV-2, lo que sugiere que estas células inducidas por la vacuna pueden contribuir a la inflamación del hígado en este contexto.
Palabras clave
Introducción
La vacunación es la estrategia clave para luchar contra la pandemia mundial de COVID-19 . No hubo señales de seguridad contra la hepatitis en los ensayos de vacunación contra la COVID-19, 1 sin embargo, varios informes han asociado recientemente afecciones similares a la hepatitis autoinmune (AIH) con las vacunas contra la COVID-19. [2] , [3] , [4] , [5] , [6] , [7] , [8] , [9] , [10] , [11]Hasta donde sabemos, no se informó ningún caso grave con insuficiencia hepática que requiriera trasplante de hígado. Se observó daño hepático después de las vacunas de ARNm y basadas en vectores, mientras que el tiempo desde la administración de la vacuna hasta la aparición de los síntomas osciló entre 4 días después de la primera dosis y 6 semanas después de la segunda dosis. Un paciente volvió a ser expuesto a la vacuna, lo que provocó un empeoramiento de la lesión hepática. 11 No está claro si la asociación informada de AIH con la vacunación es una coincidencia, podría reflejar una lesión hepática transitoria inducida por fármacos o podría implicar una activación inmunitaria específica de antígeno inducida por SARS-CoV-2 única. 12 Sin embargo, el hecho de que también ocurrieran condiciones similares a la HAI después de la infección por SARS-CoV-2 13sugiere que este último podría ser un factor impulsor de los casos esporádicos.
En este documento, describimos el caso de un hombre de 52 años que presentó hepatitis aguda mixta hepatocelular/colestásica después de la primera dosis de la vacuna de ARNm BNT162b2 y hepatitis grave después de la segunda dosis. La evaluación diagnóstica fue compatible con los criterios de HAI. Después del inicio de la terapia con budesonida oral , las pruebas de función hepática mejoraron durante un mes antes de que ocurriera una recaída que se trató con éxito con prednisolona sistémica y ácido ursodesoxicólico . Evaluación inmunológica integral de los infiltrados inflamatoriosen el hígado reveló la presencia de un infiltrado de células T CD8 citotóxicas altamente activadas que incluía una población de células T CD8 específicas de SARS-CoV-2 que se correlacionó con la activación periférica de células T CD8 específicas de SARS-CoV-2, lo que indica que la hepatitis posterior a la vacunación contra la COVID-19 implica respuestas inmunitarias específicas de antígeno provocadas por la vacunación con características histológicas distintas en comparación con la HAI auténtica.
Pacientes y métodos
Muestras de pacientes
Un hombre de 52 años y 3 trabajadores de la salud (todos HLA-A∗03:01, confirmado por NGS)> 26 días después de la vacunación de refuerzo (dpb) que recibieron la vacuna de ARNm BNT162b2 fueron reclutados en el Centro Médico Universitario de Freiburg, Alemania . Se obtuvo el consentimiento informado por escrito de todos los participantes. Además, se obtuvieron 5 muestras de tejido hepático sano (tejido distante de metástasis hepática de cáncer colorrectal) del Instituto de patología quirúrgica de Friburgo. El estudio se realizó de acuerdo con las pautas federales y las regulaciones del comité de ética local (Albert-Ludwigs-University Freiburg, Alemania; voto: #21-1135 y #21-1372) y la Declaración de Helsinki (1975).
Citometría de masas de imágenes
El tejido hepático se obtuvo mediante biopsia transcutánea, se fijó en formalina, se incluyó en parafina, se cortó en secciones de 4 μm y se tiñó como se describió anteriormente. 25 Brevemente, después de la desparafinización, rehidratación , recuperación de antígenos y bloqueo, los portaobjetos se tiñeron con anticuerpos marcados con metal y se secaron al aire. La adquisición de imágenes de la biopsia (30,912 mm 2 ) y 2,25 mm 2 de las muestras de control se realizó utilizando un sistema de imágenes Hyperion (Fluidigm; EE. UU.). Las regiones de interés se eliminaron con láser punto por punto a 200 Hz, lo que resultó en una resolución de píxel de 1 μm 2. La visualización de imágenes se realizó con FIJI (v1.52p, ImageJ). La segmentación de celdas individuales se llevó a cabo mediante un canal de análisis supervisado e imparcial adaptado mediante Ilastik (v 1.3.3) y CellProfiler (v 3.1.9). Para analizar las zonas del hígado, se calculó la distancia de cada píxel a GLUL, CD34 y α-SMA usando CellProfiler (v 4.0.4), se agregó a la información de alta dimensión de cada celda y se usó para compuerta en OMIQ (Omiq Inc). Se definieron zonas hepáticas: centrolobulillar (distancia a GLUL ≤50 μm), periportal (distancia a GLUL >50 μm y distancia a CD34 y α-SMA ≤50 μm) e intermedia (distancia a GLUL >50 μm y distancia a CD34 y α-SMA ≤50 μm) -SMA >50 μm). Los recuentos absolutos de células se normalizaron a 1 mm 2 . Los diagramas de barras apilados se crearon con R versión 4.0.1 usando ggplot2.
aislamiento de PBMC
Las células mononucleares de sangre periférica (PBMC) se aislaron de muestras de sangre anticoaguladas después de la centrifugación en gradiente de densidad y posteriormente se almacenaron a -80 °C hasta su uso posterior.
Suspensión unicelular de biopsia hepática
El tejido hepático restante se homogeneizó mecánicamente y se filtró a través de un filtro de células de 70 µm (Corning). Las células se lavaron y se procesaron directamente para el análisis de citometría de flujo. Además, las PBMC recién aisladas también se tiñeron y analizaron mediante citometría de flujo.
Análisis de células T CD8 específicas de espiga
El péptido de la espiga del SARS-CoV-2 (S 378-386 : KCYGVSPTK) se sintetizó con una pureza de >70 % (Genaxxon Bioscience), se cargó en HLA-A∗03:01 easYmers® (immunAware) y posteriormente se conjugó con fioceritrina (PE )-estreptavidina (Agilent) según las instrucciones del fabricante. Las células T CD8 específicas de Spike(A∗03/S 378 ) se analizaron después del enriquecimiento basado en perlas magnéticas como se describió anteriormente. 10 En resumen, las PBMC se incubaron con EasYmers HLA-A∗03:01 tetramerizado conjugado con PE S 378-386 cargado. De manera similar, las células T CD8 específicas de EBV se detectaron usando LMP-1 419-427 tetramerizado conjugado con PEEasYmers HLA-A∗24:02 cargados. Las células T CD8 específicas de virus se enriquecieron mediante la tecnología MACS utilizando perlas anti-PE. Posteriormente, tanto las muestras enriquecidas como las preenriquecidas se analizaron mediante citometría de flujo multiparamétrica. Las frecuencias de células T CD8 específicas de pico se calcularon como se describió anteriormente. 10 , 11 Las muestras enriquecidas con menos de 5 células T CD8 específicas de virus se excluyeron del análisis final, lo que resultó en un límite de detección de 5*10 -6 células T CD8 específicas de virus.
Citometría de flujo multiparamétrica
Los anticuerpos utilizados para el análisis de citometría de flujo se enumeran en la tabla CTAT complementaria . FoxP3/Factor de transcripción del juego de tampones de tinción (Thermo Fisher) y el kit de solución de fijación/permeabilización (BD Biosciences) se utilizaron para moléculas intranucleares y citoplasmáticas, respectivamente. Después de la fijación de las células en paraformaldehído/PBS al 2% (Sigma), se realizó la adquisición en LSRFortessa (BD). Los datos se analizaron con FlowJo, LLC (BD).
Reducción dimensional de datos de citometría de flujo multiparamétricos
La reducción de dimensionalidad se llevó a cabo con R versión 4.1.1 utilizando Bioconductor (versión 3.13) CATALYST (Versión 1.16.2). Los análisis se realizaron en células T CD8+ vivas no ingenuas, incluidos los marcadores CD137 , CD39, CD38, CXCR3, CD127, CXCR6, PD-1. Se realizó una reducción de la muestra a 45.000 células. Las intensidades de los marcadores se transformaron mediante arcsinh (seno hiperbólico inverso) con un cofactor de 150. La reducción de la dimensionalidad de los datos transformados se realizó mediante incrustaciones de vecinos estocásticos distribuidos en t.
ELISA
Los anticuerpos de unión a picos se evaluaron mediante Anti-SARS-CoV-2-QuantiVac-ELISA (IgG) (Euroimmun) detectando S1 IgG (<25,6 BAU/ml: negativo; 25,6-35,1 BAU/ml: marginalmente positivo; ≥35,2 BAU/ ml: positivo) según las instrucciones del fabricante.
Resultados
Curso clínico
El paciente varón de 52 años sin antecedentes médicos de interés aparte de hipotiroidismo preexistente bajo terapia de sustitución a largo plazo con levotiroxina y pruebas de función hepática (LFT) históricas normales desarrolló náuseas progresivas, fatiga, pérdida de apetito y prurito con síntomas que comenzaron aproximadamente 10 días después de la primera dosis (principal) de la vacuna de ARNm BNT162b2. Posteriormente desarrolló ictericia y se presentó en su médico de atención primaria con LFT indicativo de hepatitis aguda mixta hepatocelular/colestásica (alanina aminotransferasa [ALT] 2130 U/L, fosfatasa alcalina [ALP] 142 U/L, gamma-glutamiltransferasa [GGT] 217 U /L, bilirrubina 7,7 mg/dl) ( Fig. 1). El paciente ingresó en un centro de atención primaria 25 días después de la primera vacunación. Las hepatitis virales A, B, C y E, así como las infecciones por citomegalovirus y virus de Epstein-Barr se excluyeron mediante serología y/o pruebas de PCR. El genotipado de HFE no reveló variaciones asociadas a la hemocromatosis. Tampoco hubo un consumo significativo de alcohol y la serología autoinmune no fue concluyente con reactividad limítrofe anti-mitocrondrial-M2 (AMA-M2). El paciente se recuperó rápidamente sin terapia específica y fue dado de alta con LFT decrecientes después de 3 días bajo el diagnóstico diferencial principal de una hepatitis tóxica . Durante las próximas 2 semanas, las enzimas hepáticasdisminuyó aún más, con la normalización de AST y ALP y el paciente recibió su segunda dosis (refuerzo) de la vacuna de ARNm BNT162b2 41 días después de la primera vacunación ( Fig. 1 ). Vacunación de 20 dpb, el paciente volvió a experimentar náuseas y fatiga. Los exámenes de laboratorio revelaron una recidiva de hepatitis aguda mixta con (ALT 1.939 U/L, ALP 167 U/L, bilirrubina 2,9 mg/dl). Posteriormente fue derivado a nuestro centro de tercer nivel a los 26 dpb. Se repitió la serología autoinmune con hiperglobulinemia leve (niveles de IgG 1,02 veces del límite superior de lo normal, niveles normales de IgA e IgM), anticuerpos antinucleares (1:200) y positividad limítrofe para anticuerpos antimúsculo liso y AMA-M2, mientras que las pruebas de anticuerpos anti-hígado-riñón-microsomales permanecieron negativas. Realizamos una biopsia hepática.que histológicamente mostró hepatitis de interfase con moderado grado de infiltrado linfoplasmocitario y focos de necrosis lobulillar y apoptosis . Granulocitos eosinofílicos no estaban presentes. No se observó fibrosis perisinusoidal ni portal relevante. En conjunto, estos hallazgos son compatibles con una HAI probable según la puntuación original revisada para la HAI 14 y el paciente fue tratado con 9 mg de budesonida oral por día. Durante las siguientes semanas, las enzimas hepáticas disminuyeron antes de que ocurriera una recaída 39 días después del inicio de la terapia (66 dpb), que se controló posteriormente después de escalar a esteroides sistémicos en combinación con ácido ursodesoxicólico. Las LFT del paciente se normalizaron posteriormente en 8 semanas ( Fig. 1 ). Los anticuerpos anti-spike no mostraron fluctuaciones importantes con títulos similares en comparación con individuos sanos en el momento del diagnóstico a los 27 dpb de vacunación ( Fig. 1 B) y una reducción esperada de los títulos con el tiempo ( Fig. 1 C).

- Descargar : Descargar imagen de alta resolución (460KB)
- Descargar: Descargar imagen a tamaño completo
Figura 1 . Curso clínico con hepatitis después de la vacunación BNT162b2.
(A) Evolución temporal de los niveles de ALT , AST, ALP , GGT y bilirrubina después de la vacunación con BNT162b2 en el paciente. Las flechas indican el punto de tiempo de vacunación de refuerzo y cebado con BNT162b2. Las puntas de flecha indican el momento de la biopsia hepática . La duración y la dosis del tratamiento con budesonida (9 mg/día) y prednisolona (inicialmente 50 mg/día) se muestran en coloración azul claro y gris. (B) Comparación de los títulos de anticuerpos IgG anti-spike S1 entre pacientes y vacunas coincidentes en el tiempo que no desarrollaron hepatitis. (C) Análisis longitudinal de anticuerpos IgG anti-spike S1 antes y después del inicio de la terapia. ALP, alanina fosfatasa ; ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; dpb, impulso posterior a los días; GGT, gamma-glutamiltransferasa.
Análisis inmunológico espacial profundo del tejido hepático
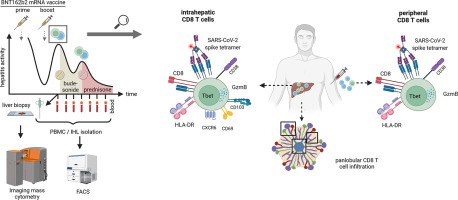
Para comprender el infiltrado inmunitario en el hígado con más detalle, además de la histoquímica convencional , realizamos una citometría de masas de imágenes altamente multiplexada con un amplio panel que abarca poblaciones inmunitarias relevantes ( tabla CTAT complementaria ). Como se muestra en la Fig. 2A , esto reveló infiltrados que consistían en células T, macrófagos, células B, células plasmáticas y granulocitos en el hígado. El número absoluto de células inmunitarias aumentó 5,3 veces en comparación con el tejido hepático de control no enfermo obtenido de resecciones hepáticas ( Fig. 2 B). Curiosamente, entre el infiltrado inmunitario, las células T CD8 representaron el subconjunto de células inmunitarias más abundante (465 por mm 2), lo cual fue inesperado para AIH. Por el contrario, las células B y las células plasmáticas que suelen estar enriquecidas en HAI se encontraron en cantidades relativamente bajas (102 por mm 2 y 66 por mm 2 , respectivamente), aunque estas poblaciones también estaban enriquecidas en el infiltrado inmunitario en comparación con los controles ( Figura 2 E). Estos hallazgos sugirieron una contribución diferente de las células inmunitarias en comparación con la HAI espontánea típica. Luego evaluamos la localización espacial de los diferentes subconjuntos de células inmunes dentro del parénquima hepático . La infiltración inmune más fuerte se observó en las áreas periportales ( Fig. 2C). En particular, mientras que las células B y las células plasmáticas también estaban enriquecidas pero predominantemente presentes en las áreas periportales, la distribución de las células T CD8 era panlobular ( Fig. 2 C, D). Para evaluar los correlatos inmunológicos del daño hepático, evaluamos el marcador de gránulos citotóxicos Granzyme B. Curiosamente, observamos una fuerte acumulación de células T CD8 citotóxicas (Granzyme B-positivas) mientras que otros subconjuntos de células inmunes que expresan Granzyme B, como los granulocitos, no aumentaron ( Fig. 2 E). Estos datos también están en línea con nuestra observación de una mayor expresión intrahepática de CD38, HLA-DR y factor de transcripción T-bet como marcadores de células T efectoras activadas ( Fig. 2A,F). En base a su fuerte enriquecimiento, distribución ampliamente dispersa y fenotipo citotóxico activado dentro del parénquima hepático, especulamos que las células T CD8 podrían ser impulsoras de la inflamación hepática.

figura 2 El análisis espacial profundo del entorno inmunitario hepático revela una infiltración inmunitaria dominada por células T CD8 citotóxicas.
La biopsia hepáticafue analizado por IMC altamente multiplexado. (A) Imágenes IMC pseudocoloreadas de la biopsia hepática. Arriba a la izquierda: la visualización compuesta de CD45, CK7, CD34, LYVE1, a-SMA y ADN se indica mediante colores. La visualización de marcador único se muestra para los marcadores representados en el borde izquierdo de las visualizaciones. Una región de interés se indica mediante el cuadro y se detalla en una resolución más alta. Las barras de escala indican 500 μm y 200 μm en las inserciones, respectivamente. (B) Los recuentos de células de los subconjuntos de células inmunitarias en el hígado se muestran como gráficos de barras apilados en comparación con los controles. (C) Imagen IMC compuesta que visualiza ejemplos de zonas hepáticas definidas por marcadores estructurales: zonas periportales (arriba), intermedias (medias) y centrolobulillares (abajo). Recuentos de células inmunitarias dentro de las regiones definidas visualizadas como gráficos de barras apilados junto a las respectivas inserciones. Las barras de escala indican 200 μm y 100 μm en las inserciones, respectivamente. (D) El enriquecimiento de las poblaciones inmunitarias indicadas se calculó dividiendo la densidad celular en la muestra del paciente por la media de las muestras de control. (E) Distribución de células T CD8 positivas para GrzB yrecuentos de células de granulocitos dentro de las zonas del hígado. (F) La frecuencia (izquierda) y la densidad celular (derecha) de las células T HLA-DR+ CD38+ CD8 se muestran para el paciente con hepatitis y los controles. GrzB, granzima B ; IMC, citometría de masas de imágenes .
Inmunofenotipificación periférica intrahepática y longitudinal de las respuestas de células T CD8 asociadas a la vacunación
A continuación, realizamos un análisis detallado de las poblaciones de células T CD8 intrahepáticas y periféricas mediante citometría de flujo. La población de células T CD8 intrahepáticas del paciente se enriqueció con marcadores de residencia tisular (CXCR6, CD69 y CD103) y activación (CD38) ( Fig. 3A ). La expresión de CD38 en células T CD8 también se observó en la sangre periférica. Curiosamente, los niveles de expresión de CD38 se elevaron notablemente en el paciente en comparación con los vacunados de control emparejados en el punto de tiempo posterior a la vacunación que no desarrollaron hepatitis (75,9 % frente a 15,4 %, respectivamente) ( Fig. 3B). La expansión inusual de las células T citotóxicas activadas observada en nuestro análisis espacial nos llevó a plantear la hipótesis de que las células T CD8 específicas del SARS-CoV-2 inducidas por la vacunación podrían contribuir a la enfermedad hepática, ya que hemos observado recientemente una rápida inducción del SARS-CoV-2 Células T CD8 específicas de pico por la vacuna de ARNm BNT162b2. 15 De hecho, utilizando un tetrámero HLA-A∗03 emparejado con el paciente cargado con un epítopo de pico de SARS-CoV-2 (S 378-386 ), identificamos células T CD8 específicas de pico. En la sangre periférica, las células T CD8 específicas de pico fueron 10,2 veces más abundantes que las células T específicas para un epítopo de control de células T CD8 específico de EBV ( Fig. S1). También identificamos células T CD8 específicas de pico en el hígado. En comparación con la sangre periférica, el grupo de células T CD8 intrahepáticas se enriqueció ∼3,4 veces en células T CD8 específicas de espiga ( Fig. 3 C) y mostró características residentes en tejido (CXCR6, CD103, CD69) y una fuerte activación como se indica por expresión de CD38 ( Fig. 3C). La proteína espiga no se identificó en el hígado en el momento del análisis por inmunohistoquímica (datos no mostrados). A continuación, preguntamos si la frecuencia y el fenotipo activado de las células T CD8 específicas de pico circulantes se mantuvieron durante la terapia. Curiosamente, los análisis longitudinales mostraron frecuencias estables de células T CD8 específicas de pico circulantes ( Fig. 3D) con niveles de expresión de CD38 decrecientes después del inicio de la terapia con budesonida y coincidiendo con niveles de transaminasas decrecientes . Sin embargo, la expresión de CD38 en células T CD8 específicas de pico y otros marcadores asociados con la citotoxicidad, como GrzB y T-bet, aumentó cuando el paciente recayó bajo la terapia con budesonida, luego se normalizó después de la introducción de la terapia inmunosupresora sistémica ( Fig. 3 E-G). Este patrón no se observó para las células T CD8 específicas de EBV restringidas con HLA-A∗24:02 cargadas con LMP-1 419-427 ( Fig. S1 ). Tampoco se observó para los análisis de células T CD8 a granel, que mostraron una gran abundancia de poblaciones de células T CD8 citotóxicas activadas en la periferia ( Fig. 3P.EJ). En resumen, estos datos indican una amplia activación de las células T CD8 citotóxicas con el fenotipo periférico de células T CD8 específicas de pico que refleja el patrón de respuesta clínica a la terapia inmunosupresora.

Figura 3 . El inmunofenotipo de células T CD8 periféricas y obtenidas por vacuna se correlaciona con la gravedad de la hepatitis.
(A) Representación t-SNE de datos de citometría de flujo que comparan células T CD8+ no ingenuas de 27 dpb en el hígado (rojo) y la sangre (azul) del paciente. Se indican los niveles de expresión de CXCR6, CD69, CD103 y CD38 (azul: baja expresión; rojo: alta expresión). (B) Niveles de expresión cuantificados de CD38, 27 dpb en linfocitos T CD8+ no vírgenes en el hígado (rojo) y la sangre (azul) del paciente en comparación con vacunados coincidentes en el tiempo sin desarrollo de hepatitis. (C) Gráficos bivariados originales que muestran frecuencias de células T CD8+ específicas de pico (A∗03/S378) dentro de la población de células T CD8+ a 27 dpb, hígado (rojo) y sangre (azul). Se indican los niveles de expresión de CXCR6, CD69, CD103 y CD38 de células T CD8+ específicas de pico. (D) Análisis longitudinal de ex vivo calculadofrecuencias de células T CD8+ específicas de espiga. (E) El análisis longitudinal de las células T CD38, (F) GrzB, (G) Tbet+CD38hi CD8+ se muestra con los niveles de ALT (U/L) coincidentes en el tiempo representados en gris con puntos conectados, circulando CD8+ no ingenuo específico del pico Células T (círculo azul) y células T CD8+ a granel no ingenuas (círculo gris abierto). El fondo de color indica el régimen de tratamiento del paciente (azul claro: budesonida , gris: prednisolona). ALT, alanina aminotransferasa; dpb, impulso posterior a los días; GrzB, granzima B.
Discusión
La enfermedad similar a la HAI después de la vacunación contra el SARS-CoV-2 ahora se reconoce como un evento adverso raro que no se identificó en los primeros ensayos. El uso generalizado de la vacuna con la administración de cientos de millones de dosis en todo el mundo también plantea cuestiones de causalidad frente a coincidencia. En particular, se notificó enfermedad similar a la HAI después de la vacunación en pacientes con características de edad y sexo típicas de la HAI espontánea. 6 , 7 , 10 Si bien algunos de estos casos pueden representar una coincidencia, también es posible una relación causal con la vacuna, como la hepatitis del transeúnte provocada por la elevación de las citocinas o quimiocinas sistémicas.después de la vacunación, similar a los casos que ocurren en asociación con la infección natural por SARS-CoV-2. 13 Los diferentes patrones de manifestación clínica y la amplia gama de tiempo transcurrido entre la administración de la vacuna y el inicio de los síntomas sugieren claramente que diferentes mecanismos pueden contribuir a estos casos notificados. Aquí, nuestro análisis destaca que las células T CD8 citotóxicas activadas, incluidas las células T CD8 específicas de pico inducidas por la vacuna, podrían contribuir a la patogénesis de la enfermedad.
Es importante destacar que la AIH es una condición que requiere terapia inmunosupresora de por vida en muchos pacientes afectados. 16 Por lo tanto, es importante diferenciar la HAI de la posible hepatitis transitoria mediada por el sistema inmunitario después de la vacunación. El diagnóstico de AIH generalmente se establece utilizando herramientas de puntuación de AIH informadas por LFT , serología de autoanticuerpos y características histológicas típicas como hepatitis de interfaz y enriquecimiento de células plasmáticas. 14 En nuestro caso, antes de la terapia, el diagnóstico de HAI se consideró «probable» según la puntuación original de HAI modificada. Es importante señalar en este contexto que el primer episodio de hepatitis agudadespués de la primera dosis de la vacuna fue autolimitante sin terapia, lo que también guió nuestra elección de iniciar la terapia con budesonida en un intento de minimizar los efectos secundarios sistémicos y mantener la inmunidad sistémica anti-SARS-Cov2 si es posible. Sin embargo, nuestro paciente experimentó una recaída 3-4 semanas después de la terapia con budesonida y luego requirió terapia con esteroides sistémicos , que se combinó empíricamente con ácido ursodesoxicólico , una combinación utilizada en el tratamiento del síndrome de superposición de HAI que se eligió debido a la presencia de AMA- Los anticuerpos M2 se encuentran típicamente en la colangitis biliar primaria . 17 El paciente posteriormente se recuperó rápidamente, con gingivitissiendo el único evento adverso posible relacionado con la inmunosupresión. Debido a la recaída de la hepatitis después de la reducción gradual de los esteroides, el paciente recibió una terapia inmunosupresora de mantenimiento a largo plazo con la que logró una remisión bioquímica completa .
Mecánicamente, la manifestación de la enfermedad en nuestro paciente fue distinta de la HAI espontánea clásica, que típicamente se asocia con inmunoglobulinas periféricas elevadas, un infiltrado dominado por células plasmáticas y una hepatitis de interfaz prominente. Aquí, aunque hubo una ligera elevación de las inmunoglobulinas periféricas y un enriquecimiento intrahepático de células B y células plasmáticas intrahepáticas, se observó una correlación más llamativa a nivel de células T CD8 citotóxicas. Las células T CD8 citotóxicas activadas se enriquecieron fuertemente en el hígado del paciente hasta el punto de representar la población de células inmunitarias intrahepáticas más abundante e incluyeron respuestas específicas del SARS-CoV-2 provocadas por la vacuna. Notablemente, el estado de activación periférica de estas células T CD8 específicas de pico se correlacionó con la gravedad de la hepatitis y el curso clínico después de la introducción de la terapia inmunosupresora. Estos resultados implican a las células T como un tipo de célula inmunitaria patógena de esta hepatitis inmunitaria asociada a la vacuna. El incremento inicial deLos valores de ALT después de la primera y segunda dosis de BNT162b2 y la observación de que las células T CD8, incluidas las células T CD8 específicas de la espiga, dominan el infiltrado inmunitario también encajan con las observaciones recientes de una movilización temprana de las células T CD8 específicas de la espiga después de la primera dosis del vacuna. 15 Cabe destacar que nuestro tetrámeroEl reactivo probablemente tiñe solo una fracción de las células T específicas de antígeno inducidas por la vacunación, lo que se ajusta a la amplia expresión de los marcadores de activación y citotoxicidad de las células T observados en el análisis de la población total de células T CD8. Sin embargo, también es posible que el amplio patrón de activación observado involucre a otras poblaciones de células T CD8 «espectadoras» no específicas del SARS-CoV-2. Además, el mecanismo preciso que causa la infiltración de células T CD8 específicas de pico en el hígado, en el que adoptan características de células T de memoria residentes en tejidos, sigue sin estar claro. Las células T CD8 específicas del virus pueden acumularse en el hígado incluso si el sitio primario de infección está distante, como durante la infección por influenza, y es posible que el hígado actúe como un «cementerio» para las células T activadas. 18 ,19 Sin embargo, las células T CD8 citotóxicas activadas pueden mediar en la hepatitis incluso en ausencia de antígeno. 20 Además, la citotoxicidad similar a la innata, independiente del receptor de células T, de las células T testigo se ha descrito en infecciones agudas. 21 , 22 Es de destacar que las células T de memoria CXCR6+ CD8+ residentes en tejido, como las que se encuentran en este paciente, pueden mediar la autoagresión en enfermedades metabólicas del hígado , en respuesta a señales inflamatorias locales. 23 , 24 Si bien estos informes plantean la posibilidad de una hepatitis mediada por células T independiente de antígeno, otra posible explicación podría ser la presencia de su antígeno afín, es decir ,la proteína espiga. Si bien no pudimos detectar la proteína de pico mediante inmunohistoquímica en el hígado, debe tenerse en cuenta que la biopsia se realizó 27 días después de la segunda dosis de la vacuna y la expresión transitoria después de la vacunación, lo que podría haber causado que las células T CD8 específicas de pico que expresan CXCR6 regresen a casa. al hígado y a las células presentadoras de antígeno diana, no se puede excluir. Sin embargo, mecanismos adicionales, como el reconocimiento cruzado de antígenos, también pueden contribuir a la inmunopatología . En resumen, la vacuna BNTb163b2 puede desencadenar una hepatitis inmunomediada por mecanismos relacionados con la inmunidad celular inducida por la vacuna. Este caso ilustra la inducción de una AIH dominante de células T CD8 inusual después de la vacunación con ARNm de BNT162b2, con enriquecimiento de células T CD8 específicas de SARS-Cov2 inducidas por la vacuna. En pacientes con hepatitis que se manifiesta después de la primera dosis de la vacuna, las dosis adicionales pueden desencadenar una autoinmunidad hepática significativa que requiere inmunosupresión a largo plazo.
TRADUCIDO DE : sciencedirect